180일 걸리던 코로나 백신 심사, 40일로 확 줄인다
전체 맥락을 이해하기 위해서는 본문 보기를 권장합니다.
정부가 신종 코로나바이러스 감염증(코로나19) 백신 및 치료제의 심사 및 허가 기간을 기존의 4분의 1 수준으로 대폭 줄인다.
식품의약품안전처는 27일 품목별 사전 검토 및 허가전담심사팀의 신속한 심사를 통해 기존 180일가량 소요되는 처리 기간을 40일 이내로 처리하겠다는 계획을 밝혔다.
식약처는 코로나19 백신과 치료제의 신속한 심사를 위해 허가전담심사팀을 구성, 운영한다.
이 글자크기로 변경됩니다.
(예시) 가장 빠른 뉴스가 있고 다양한 정보, 쌍방향 소통이 숨쉬는 다음뉴스를 만나보세요. 다음뉴스는 국내외 주요이슈와 실시간 속보, 문화생활 및 다양한 분야의 뉴스를 입체적으로 전달하고 있습니다.
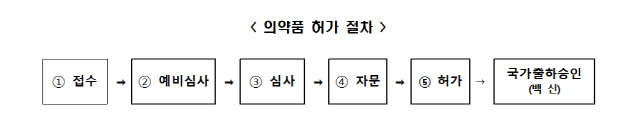
식품의약품안전처는 27일 품목별 사전 검토 및 허가전담심사팀의 신속한 심사를 통해 기존 180일가량 소요되는 처리 기간을 40일 이내로 처리하겠다는 계획을 밝혔다.
백신은 생물학적 제제기 때문에 접수→예비심사→심사→자문→허가로 진행되는 일반 의약품과 달리 국가출하승인 절차를 한 번 더 거쳐야 한다. 식약처는 허가 절차는 그대로 유지하면서 심사 기간을 단축해 백신 공급을 앞당긴다는 것이다.
현재 허가 절차에 따르면 업체는 허가 신청 시 약사법에 따라 허가에 필요한 자료를 식약처의 ‘의약품 안전나라’에 제출해야 한다. 허가 이후 백신은 국가출하승인을 거쳐야 유통 및 판매가 가능하다. 국가출하승인은 국내 유통 전 업체에서 신청하며 식약처에서 제조번호별 품질 검사를 실시해 승인한다.
식약처는 코로나19 백신과 치료제의 신속한 심사를 위해 허가전담심사팀을 구성, 운영한다. 업체에서 제출한 자료에 대해 분야별 전문가의 심사 결과와 필요 시 중앙약사심의위원회 등 외부 전문가의 자문 의견을 종합해 최종 허가하는 것으로 기존 180일 이상 걸리는 기존 처리 기간을 단축해 40일 이내에 처리하는 것을 목표로 하고 있다. 또한 통상 2~3개월 걸리는 국가출하승인 절차 역시 20일 이내에 처리하는 것을 목표로 추진하겠다는 계획이다.
이 같은 식약처의 계획은 이날 정부의 백신 접종 계획 언급과 관련이 깊다. 노영민 대통령 비서실장은 이날 “2·4분기에 백신 접종을 시작하게 될 것”이라고 말했다. 이미 방역 당국이 1·4분기에 아스트라제네카의 백신을 도입하겠다고 발표한 만큼 절차를 간소화해 백신 접종 일정도 앞당기려는 것으로 풀이된다.
현재 백신은 전 세계 다수 업체에서 임상 3상 시험을 진행 중이다. 이달 25일 기준 화이자 백신은 미국·영국 등 8개국에서 긴급 사용 승인을 받았으며 유럽연합·스위스에서 조건부 허가를 받았다. 모더나 백신은 미국에서 긴급 사용 승인을 받았다. /서지혜기자 wise@sedaily.com
Copyright © 서울경제. 무단전재 및 재배포 금지.
- "내년 2월 의료진·고령자 접종 시작".. 일반인은 언제?
- 2,000년 전 로마 서민들의 밥상은…폼페이서 간이 식당 발견
- [국정농담] 정부가 퍼뜨린 '가짜뉴스'는 누가 '엄벌' 합니까
- 내일부터 은행 대기고객 10명 넘으면 밖에서 줄선다
- 유시민 새해소망에…윤희숙 '헨리 조지가 놀랄 것' 서민 '쫄딱 망했으면'
- 얼굴에 필러 맞은 사람, 모더나 백신 접종하면 염증 생긴다?
- 이재명 "'대선' 손들고 나서진 않아도 대비는 하고 있다"
- 내년 초강력 부동산 '세금 폭탄' 온다…전세 시장 또 요동?
- 공정에 목마른 사회...서울대 책 대여 1위는 '정의란 무엇인가'
- 영업금지 소상공인에 임대료 100만원 현금지원 윤곽